Лекция 1.
Введение. Генная и клеточная инженерия: цели и задачи, краткая история, проблемы и перспективы развития в пищевой промышленности
Биотехнология — это применение биологических процессов и использование живых организмов в промышленности, медицине, сельском хозяйстве и других отраслях человеческой деятельности.
Несмотря на то, что биологические процессы издавна используются человеком в хлебопечении, сыроварении, виноделии, пивоварении, научный этап развития биотехнологии начался с 70-х годов XIX века с открытием JI. Пастером процесса брожения, а столетием позже биотехнология превратилась в бурно развивающуюся отрасль. В настоящее время прогресс в области биотехнологии тесно связан с применением методов генной и клеточной инженерии, а также клонированием.
В качестве основных направлений биотехнологии рассматриваются получение продуктов питания, кормовых добавок и ценных кормовых белков, лекарственных препаратов и средств диагностики, биотоплива, борьба с загрязнением окружающей среды, защита растений от вредителей и болезней, а также создание штаммов микроорганизмов, сортов растений и пород животных с новыми полезными свойствами.
В настоящее время в хлебопекарной и кондитерской промышленностях, пивоварении и виноделии применяются различные штаммы дрожжей. Благодаря способности осуществлять спиртовое брожение для них нашлось место и в технологиях выработки биотоплива, например, биодизеля из растительного сырья, особенно рапса. Другие микроскопические грибы широко используют для получения кефира, сыров, антибиотиков, лимонной кислоты, кормовых белков и т. д.
Без бактерий невозможно получить никакие кисломолочные продукты, в том числе кефир, йогурт и сыры. Брожение, осуществляемое молочнокислыми бактериями, используется и в процессах приготовления квашеных овощей, а также силоса, поскольку накапливающиеся при этом продукты реакции угнетают развитие других микроорганизмов. Не меньшую роль бактерии играют и в фармацевтической промышленности, где они культивируются с целью получения витаминов, гормонов и ферментов. Первой микробиологический синтез гормона инсулина с помощью методов генной инженерии «освоила» кишечная палочка Escherichia coli.
Очистка окружающей среды ведется в основном в двух направлениях: разложение органических остатков и накопление отдельных химических элементов, органических и неорганических веществ некоторыми видами бактерий, водорослей и простейших. С помощью методов селекции и генной инженерии уже выведены штаммы бактерий, способные разлагать соединения, утилизировать которые встречающиеся в природе виды неспособны, например пластмассы и полиэтилен. В процессе расщепления органических остатков бактерии могут выделять и горючие газы, в том числе метан, что легло в основу технологий получения биогаза из отходов растениеводства и животноводства.
В связи с тем, что бактерии, грибы и вирусы способны эффективно бороться с вредителями сельского и лесного хозяйства, а также с возбудителями и переносчиками заболеваний, их штаммы используют для приготовления биопрепаратов. Преимущество этих биологических методов борьбы состоит в том, что они не только снижают численность паразитов, будучи безвредными для других организмов, но и не загрязняют при этом окружающую среду токсичными соединениями.
К основным разделам современной биотехнологии относятся: микробиологический синтез, клеточная инженерия и генная инженерия.
Используя методы генной и клеточной инженерии, современная биотехнология осуществляет широкое конструирование генетически модифицированных организмов (ГМО), в том числе микроорганизмов, растений и животных.
Целый ряд ГМО используется в неконтролируемых условиях (в сельском хозяйстве, рыбоводстве, для биологической борьбы с вредителями сельского и лесного хозяйства и т. д.).
Однако перед генной инженерией стоит ряд этических и технологических проблем. Например, при выпуске ГМО в окружающую среду они могут взаимодействовать с разнообразными организмами, сообществами и экосистемами конкретных территорий. При этом процесс и исход таких взаимодействий не всегда поддается прогнозированию.
В результате возникает проблема генетической безопасности как отдельных популяций человека, растений и животных, так и экосистем в целом. В частности, существует опасность внедрения трансгенов («искусственных генов») в геном неконтролируемых организмов в результате скрещивания и/или рекомбинации ГМО и «диких» форм.
Клеточная инженерия: цели, задачи, краткая история достижения и перспективы
Клеточная инженерия — это один из основных разделов современной биотехнологии, основанный на выделении и культивировании тканей и клеток высших многоклеточных организмов.
Культивирование тканей и клеток происходит вне организма — in vitro («в пробирке, в колбе, в стеклянной посуде»), в специально подобранных условиях.
Значение:
1- Клеточная биотехнология базируется на способности клеток к существованию и размножению in vitro, их тотипотентности и регенерации. Роль культуры изолированных клеток и тканей в биотехнологии следует рассматривать в трех направлениях. Первое связано со способностью изолированных растительных клеток продуцировать ценные для медицины, парфюмерии, косметики и других отраслей промышленности вещества вторичного синтеза: алкалоиды, стероиды, гликозиды, гормоны, эфирные масла и др.
2- Второе направление — это использование культуры изолированных тканей для размножения и оздоровления посадочного материала. Этот метод, названный клональным микроразмножением растений, позволяет получать от одной меристемы сотни тысяч растений в год.
3- Третье направление — использование изолированных клеток в селекции растений, дающее возможность получать быстрорастущие растения, устойчивые к различным неблагоприятным факторам среды: засуха, засоление, низкие и высокие температуры, фитопатогены, тяжелые металлы и др.
Краткая история.
I этап (1892—1902 гг.) связан с именами таких немецких исследователей, как Г. Хаберландт, Фёхтинг, Рехингер. Они пытались культивировать в растворе сахарозы различные растительные ткани. Для сегментов стеблей одуванчика и тополя был получен первичный каллус и определен минимальный размер сегмента, способного к каллусогенезу. Недостигнув положительных результатов, эти исследователи высказали ряд идей и гипотез, которые подтвердились значительно позже. Так, Хаберландт выдвинул гипотезу о тотипотентности любой живой растительной клетки, т.е. способности клеток реализовывать свой потенциал развития и давать начало образованию целого растения при определенных условиях культивирования.
II этап (1902—1922 гг.) ознаменовался созданием первых питательных сред для культивирования тканей животных. Эти среды были природного происхождения и содержали, как правило, плазму крови и зародышевую жидкость. Попытки вырастить изолированные растительные ткани на искусственных питательных средах, содержащих растительные экстракты, оказались неудачными, так как в экспериментах использовались мало подходящие для проявления ростовой активности клетки и ткани высших растений.
III этап (1922—1932 гг.). В этот период независимо друг от друга американский ученый В. Робине и немецкий ученый Котте показали возможность культивирования на твердых питательных средах меристемы кончиков корня томатов и кукурузы. Однако через определенное время растительные ткани бурели и погибали. Подлинное развитие метода культуры тканей растений началось с 1932 г.
IV этап (1932—1940 гг.) связан с именем французского ученого Р. Готре, который показал возможность долгого культивирования в условиях in vitro растительных тканей за счет периодического пересаживания их на свежую питательную среду. Это открытие дало новый толчок в работе по культуре ткани, который ознаменовался нарастающим числом новых объектов, успешно введенных в культуру.
V этап (1940—1960 гг.). С открытием в 1955 г. нового класса фитогормонов-цитокининов, и в частности кинетина, была получена возможность стимулировать деление клеток кусочка ткани сердцевинной паренхимы табака, лишенной проводящих пучков и камбия. В зависимости от концентрации и соотношения стимуляторов роста можно было усиливать деление клеток экспланта, поддерживать рост каллусной ткани, индуцировать морфогенез. В этот период было оценено положительное действие натуральных экстрактов типа эндосперма кокосового ореха, каштана, кукурузы и других растений для поддержания неорганизованного клеточного роста и стимуляции процессов морфогенеза в культуре каллусных тканей и клеточных суспензий.
VI этап (1960—1975 гг.). Наиболее важным событием этого периода была разработка профессором Ноттингемского университета Э.К. Коккингом метода получения ферментативным путем изолированных протопластов из корней и плодов томата и культивирования их в контролируемых условиях. Позже в 1970 г. в той же лаборатории Пауэром и сотр. было осуществлено искусственное слияние протопластов, что открыло новый путь к созданию соматических гибридов. Еще один метод, разработанный в этот период,— это микроразмножение растений в условиях in vitro с использованием меристемной культуры. Первоначально этот метод был разработан французским ученым Ж. Морелем для получения оздоровленного посадочного материала орхидей.
VII этап (1975 г.— по настоящее время). Продолжается быстрое развитие техники in vitro, изучение биологии культивируемых объектов, разрабатываются методы электрослияния изолированных протопластов, методы мутагенеза и клеточной селекции, методы получения гаплоидных растений, совершенствуется метод глубинного культивирования клеток с использованием изолированных протопластов и векторов, созданных на основе Ti- и Ri- плзид Agrobacterium tumefaciens и A. rhizogenes. С помощью методов генной инженерии разработан эффективный метод переноса генов для двудольных растений. Таким образом, за последние десятилетия был сделан большой шаг вперед в развитии технических приемов работы с изолированными тканями и клетками растений. Однако объектом исследования, как правило, служили однодольные и двудольные травянистые растения и в редких случаях — древесные.
Клеточно-тканевые культуры растений.
Основным типом культивируемой растительной клетки является каллусная — это наименее дифференцированная ткань, которая в обычных условиях возникает при повреждениях и функционирует непродолжительное время. Каллус получают из паренхимы корнеплодов, стеблей, листьев, а также из гаплоидных тканей пыльников. Культивирование клеток растений производят или поверхностным способом, или в жидкой питательной среде. В любом случае необходимо подобрать определенное соотношение компонентов питательной среды. В состав питательной среды обязательно входят: углеводы (сахароза или глюкоза), минеральные соли, витамины, регуляторы роста и развития (определенные фитогормоны); иногда добавляют дрожжевой экстракт или растительные экстракты. Поддерживается определенная температуры, кислотность, газовый состав.
Клеточно-тканевые культуры животных.
Основным типом культивируемой животной клетки являются опухолевые клетки миеломы или саркомы (раковые клетки). В то же время культивированию поддаются и другие типы клеток: клетки селезенки, фибробласты соединительной ткани, гепатоциты печени, лимфоциты и т. д. Культуры опухолевых клеток практически бессмертны, они переносят неограниченное количество пассажей (пересевов на свежую питательную среду); длительность существования культур других тканей ограничена. Простейшей питательной средой для животных клеток служит сыворотка крови, но в ряде случаев используются полусинтетические и синтетические среды.
Соматическая гибридизация. Гибридомы
Методы клеточной инженерии позволяют объединять различные типы клеток. Слияние клеток, принадлежащих к разным биологическим видам, называется соматической гибридизацией. Сущность соматической гибридизации заключается в получении синтетических культур путем слияния протопластов различных видов организмов. Для слияния клеток используют различные физические и химические методы. После слияния протопластов образуются многоядерные гетерокариотические клетки. В дальнейшем при слиянии ядер образуются синкариотические клетки, содержащие в ядрах хромосомные наборы разных организмов. При слиянии антителообразующих клеток (например, В-лимфоцитов человека) и раковых клеток (например, клеток миеломы мышей) образуются гибридомы — клеточные гибриды, сохраняющие свойства лимфоцитов (способность к образованию строго определенных антител) и свойства раковых клеток (способность к неограниченному числу делений). Гибридомы вырабатывают однородные антитела, взаимодействующие со строго определенными возбудителями заболеваний или другими антигенами. Такие антитела называют моноклональными.
Значение клеточной инженерии
1. Применение клеточных культур позволяет преодолеть многие проблемы биоэтики (биологической этики), связанные с умерщвлением животных. Поэтому культуры клеток широко используются в научных исследованиях.
2. В культуре можно выращивать строго определенные клетки в неограниченном количестве. Поэтому культуры клеток и тканей, выделенные из природного материала, широко используются при промышленном производстве биологически активных веществ. В частности, на клеточно-тканевом уровне выращиваются женьшень, родиола розовая и другие лекарственные растения.
3. Из апикальных меристем путем микроклонирования получают посадочный материал ценных сортов растений, свободный от многих болезней (например, от вирусов и микоплазм), в частности, безвирусный посадочный материал цветочных и плодово-ягодных культур. На питательной среде размножают и каллусные ткани, которые в дальнейшем дифференцируются с образованием целостных растений.
4. Решаются проблемы получения отдаленных гибридов растений. Во-первых, путем соматической гибридизации можно скрещивать растения, которые не скрещиваются обычным путем. Во-вторых, полученные отдаленные гибриды можно воспроизводить, минуя семенное размножение и мейотический фильтр.
5. На культурах клеток получают вакцины, например, против кори, полиомиелита. В настоящее время решается вопрос крупномасштабного производства моноклональных антител на основе гибридомных культур.
6. Сохраняя культуры клеток, можно сохранять генотипы отдельных организмов и создавать банки генофондов отдельных сортов и даже целых видов, например, в виде мериклонов (культур меристем).
7. Манипуляции с отдельными клетками и их компонентами используются для клонирования животных. Например, ядра из клеток кишечного эпителия головастика внедряются в энуклеированные яйцеклетки лягушки. В результате из таких яйцеклеток развиваются особи с генетически идентичными ядрами.
Генная инженерия: цели, задачи, краткая история достижения и перспективы
Генная инженерия представляет собой совокупность методов, позволяющих создавать синтетические системы на молекулярно-биологическом уровне.
Цель прикладной генетической инженерии заключается в конструировании таких рекомбинантных молекул ДНК, которые при внедрении в генетический аппарат придавали бы организму свойства, полезные для человека.
На технологии рекомбинантных ДНК основано получение высокоспецифичных ДНК-зондов, с помощью которых изучают экспрессию генов в тканях, локализацию генов в хромосомах, выявляют гены, обладающие родственными функциями (например, у человека и курицы). ДНК-зонды также используются в диагностике различных заболеваний.
Технология рекомбинантных ДНК сделала возможным нетрадиционный подход «белок-ген», получивший название «обратная генетика». При таком подходе из клетки выделяют белок, клонируют ген этого белка, модифицируют его, создавая мутантный ген, кодирующий измененную форму белка. Полученный ген вводят в клетку. Таким способом можно исправлять дефектные гены и лечить наследственные заболевания.
Если гибридную ДНК ввести в оплодотворенное яйцеклетку, могут быть получены трансгенные организмы, передающие мутантный ген потомками.
Генетическая трансформация животных позволяет установить роль отдельных генов и их белковых продуктов, как в регуляции активности других генов, так и при различных патологических процессах.
Технология рекомбинантных ДНК использует следующие методы:
- Специфическое расщепление ДНК рестрицирующими нуклеазами, ускоряющее выделение и манипуляции с отдельными генами;
- Быстрое секвенирование всех нуклеотидов очищенном фрагменте ДНК, что позволяет определить границы гена и аминокислотную последовательность, кодируемую им;
- Конструирование рекомбинантной ДНК;
- Гибридизация нуклеиновых кислот, позволяющая выявлять специфические последовательности РНК или ДНК с большей точностью и чувствительностью;
- Клонирование ДНК: амплификация in vitro с помощью цепной полимеразной реакции или введение фрагмента ДНК в бактериальную клетку, которая после такой трансформации воспроизводит этот фрагмент в миллионах копий;
- Введение рекомбинантной ДНК в клетки или организмы.
Основные этапы развития генетической инженерии
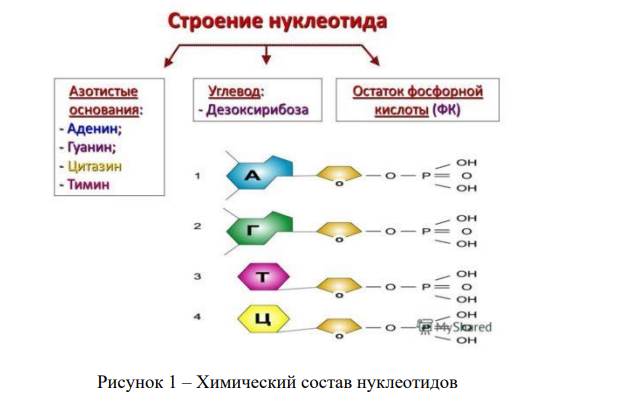
Основы классической генетики были заложены в середине XIX века благодаря экспериментам чешско-австрийского биолога Грегора Менделя. Открытые им на примере растений принципы передачи наследственных признаков от родительских организмов к их потомкам в 1865 году, к сожалению, не получили должного внимания у современников, и только в 1900 году Хуго де Фриз и другие европейские ученые независимо друг от друга «переоткрыли» законы наследственности. Параллельно с этим шел процесс формирования знаний о ДНК. Так, в 1869 году швейцарский биолог Фридрих Мишер открыл факт существования макромолекулы, а в 1910 году американский биолог Томас Хант Морган обнаружил на основе характера наследования мутаций у дрозофил, что гены расположены линейно на хромосомах и образуют группы сцепления. В первой половине двадцатого столетия ученым удалось выяснить строение основных органелл клетки, в том числе строение молекулы ДНК, которая представляла собой последовательность нуклеотидов, в состав которых входят четыре азотистых основания, дезоксирибоза и остаток фосфорной кислоты (рисунок 1).
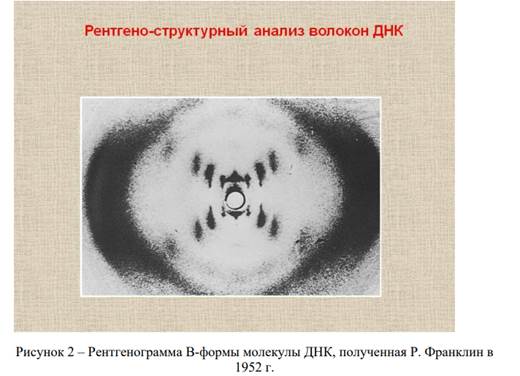
Розалинд Франклин и Морис Уилкинс в Кембриджском университете занимались рентгеноструктурными анализами молекулы ДНК. Сделанные Р. Франклин снимки со структурой молекулы (рисунок 2) послужили основой для дальнейших исследований Джона Уотсона и Фрэнсиса Крика, которые в 1953 году сделали открытие о молекулярной структуре молекулы ДНК.
Согласно модели Д. Уотсона и Ф. Крика, молекула ДНК представляет собой две цепи дезоксирибозофосфата, соединенных водородными связями между азотистыми основаниями аденина с тимином и гуанина с цитозином, напоминая ступеньки лестницы (рисунок 3). Последовательности азотистых оснований в полинуклеодитной цепи служат матрицей для синтеза новых молекул ДНК. Репликация ДНК осуществляется посредством разъединения двух цепей молекулы в местах водородных связей, после чего каждая половина достраивается, образуя новую двухцепочную молекулу ДНК.

Открытие пространственной и химической структуры молекулы ДНК, а также установление ее роли в хранении и передаче наследственной информации считается одним из наиболее важных открытий в области биологии двадцатого века. Дж. Уотсон, Ф. Крик и М. Уилкинс получили Нобелевскую премию по физиологии и медицине 1962 года «за открытия в области молекулярной структуры нуклеиновых кислот и за определение их роли для передачи информации в живой материи». В речи на презентации А. В. Энгстрем из Каролинского института охарактеризовал ДНК как «полимер, составленный из строительных блоков нескольких типов — моносахарида, фосфата и азотистых оснований... Моносахарид и фосфат — повторяющиеся элементы гигантской молекулы ДНК, кроме того, она содержит четыре типа азотистых оснований. Открытием является порядок пространственного соединения этих строительных блоков».
Практические достижения современной генной инженерии заключаются в следующем:
• созданы банки генов, или клонотеки, представляющие собой коллекции клонов бактерий. Каждый из этих клонов содержит фрагменты ДНК определенного организма (дрозофилы, человека и др.);
• на основе трансформированных штаммов вирусов, бактерий и дрожжей осуществляется промышленное производство инсулина, интерферона, гормональных препаратов. На стадии испытаний находится производство белков, позволяющих сохранить свертываемость крови при гемофилии, и других лекарственных препаратов;
• созданы трансгенные высшие организмы (некоторые рыбы и млекопитающие, многие растения) в клетках которых успешно функционируют гены совершенно других организмов. Широко известны генетически модифицированные растения (ГМР), устойчивые к высоким дозам определенных гербицидов, а также модифицированные растения, устойчивые к вредителям;
• разработаны методы клонирования строго определенных участков ДНК, например, метод полимеразной цепной реакции (ПЦР). ПЦР- технологии применяются для идентификации определенных нуклеотидных последовательностей, что используется при ранней диагностике некоторых заболеваний, например, для выявления носителей ВИЧ-инфекции.
Возможности генной инженерии практически безграничны. В настоящее время интенсивно изучается возможность коррекции генома человека (и других организмов) при генетических и негенетических заболеваниях.
Рассмотрим несколько примеров.
Нынешний этап развития генетической инженерии растений получил название «метаболическая инженерия». При этом ставится задача не столько улучшить те или иные имеющиеся качества растения, как при традиционной селекции, сколько научить растение производить совершенно новые соединения, используемые в медицине, химическом производстве и других областях. Этими соединениями могут быть, например, особые жирные кислоты, полезные белки с высоким содержанием незаменимых аминокислот, модифицированные полисахариды, съедобные вакцины, антитела, интерфероны и другие «лекарственные» белки, новые полимеры, не засоряющие окружающую среду, и многое, многое другое. Использование трансгенных растений позволяет наладить масштабное и дешевое производство таких веществ и тем самым сделать их более доступными для широкого потребления.
Важнейшим сырьем для получения разного рода химических веществ являются жирные кислоты — основной компонент растительного масла. В 1995 г. была закончена экспериментальная проверка и получено разрешение от федеральных властей США на выращивание и коммерческое использование трансгенных растений рапса с измененным составом растительного масла, включающего вместе с обычными 16- и 18-членными жирными кислотами также и до 45% 12-членной жирной кислоты — лаурата. Это вещество широко используется для производства стиральных порошков, шампуней, косметики. Экспериментальная работа заключалась в том, что был клонирован ген специфической тиоэстеразы из растения Umbellularia califonica, где содержание лаурата в жире семян достигало 70%. Структурная часть гена этого фермента под контролем промотора-терминатора гена белка, специфического для ранней стадии семяобразования, была встроена в геном рапса и арабидопсиса, что и привело к увеличению содержания лаурата в масле этих растений.
Для борьбы с насекомыми-вредителями в растениеводстве используются химические средства — инсектициды. Однако они оказывают вредное влияние на млекопитающих, убивают и полезных насекомых, загрязняют окружающую среду, дороги, и, кроме того, насекомые довольно скоро приспосабливаются к ним. Известно более 400 видов насекомых, устойчивых к используемым инсектицидам. Поэтому все большее внимание привлекают биологические средства борьбы, обеспечивающие строгую избирательность действия и отсутствие адаптации вредителей к применяемому биопестициду.
Уже довольно давно известна бактерия Bacillus thuringiensis, продуцирующая белок, являющийся очень токсичным для многих видов насекомых, в то же время безопасный для млекопитающих. Белок (дельтаэндотоксин, СКУ-белок) продуцируется различными штаммами В. thuringiensis. Взаимодействие токсина с рецепторами строго специфично, что усложняет подбор комбинации токсин-насекомое. В природе найдено большое количество штаммов В. thuringiensis, чьи токсины действуют только на определенные виды насекомых. Препараты В. thuringiensis в течение десятилетий использовали для контроля насекомых на полях. Безопасность токсина и его составных белков для человека и других млекопитающих полностью доказана. Встраивание гена этого белка в геном растений дает возможность получить трансгенные растения, не поедаемые насекомыми.
Основой биотехнологических исследований является клетка. С помощью генетической инженерии созданы супер-продуценты биологически активных веществ: бактерии, продуцирующие аминокислоты сверх своих физиологических потребностей, продуценты антибиотиков, гормонов, органических кислот.
Создаются штаммы микроорганизмов, способных к биодеструкции нефти, органических промышленных и бытовых отходов, синтетических полимеров, а также микроорганизмы, способные существовать в экстремальных условиях повышенных или пониженных температур, что расширяет области промышленного использования биотехнологических процессов. Хотя клетки микроорганизмов способны синтезировать самые разнообразные соединения, используемые в практической деятельности человека, тем не менее существует ряд веществ, которые могут образовываться только клетками растений или животных.
В этой связи ученые разработали комплекс методов, позволяющих выделять и культивировать изолированные клетки и ткани растительного или животного организма. Это очень перспективное и актуальное направление, позволяющее получать биологически активные вещества без использования целого организма в ограниченных условиях работы с биологическим материалом.
Во второй половине двадцатого века Фредериком Сенгером и Уолтером Гилбертом предложены методы, позволяющие изучать первичную структуры молекул ДНК.
Для успешного конструирования организмов с новыми заданными свойствами учеными разработаны методы синтеза и конструирования новых генов, введения их в клетку-реципиент, а также методы клонирования и идентификации рекомбинантных ДНК. В настоящее время синтез нуклеотидных последовательностей автоматизирован и осуществляется с использованием специализированного оборудования и программного обеспечения. Большое распространение получил метод полимеразной цепной реакции, позволяющий многократно увеличивать число определенных фрагментов ДНК при небольшой ее концентрации в объекте.
Метод ПЦР получил широкое распространение в медицинской диагностике, а также для идентификации и определения качества и безопасности продовольственного сырья.
Лечение заболеваний с помощью генов получило название генотерапии. Сейчас в мире насчитывается порядка 400 проектов, посвященных лечению с помощью генотерапии. Заместительная генотерапия заключается во вводе в клетку неповрежденного гена. Внесенная копия заменит по функциям сохранившийся в геноме больного дефектный ген. Все проводимые сегодня клинические испытания используют внесение в клетку дополнительных количеств ДНК.
При корректирующей терапии предполагается замена дефектного гена нормальным в результате рекомбинации. Пока этот метод на стадии лабораторных испытаний, так как эффективность его еще очень низка, но последние исследования показывают успехи в лечении некоторых заболеваний.
Амавроз Лебера — врожденная слепота, редкая форма наследственного заболевания, которое проявляется уже в младенчестве. Из-за дефектного гена — Retinal Pigment Epithelium, 65 kDa (RPE65) — в сетчатке умирают и не восстанавливаются светочувствительные клетки. По статистике, от амавроза Лебера страдает один человек на 81 тысячу. Болезнь сопровождается ослаблением или полной потерей зрения без анатомического нарушения структуры органов. Традиционная лекарственная терапия бессильна в борьбе с этим заболеванием. На помощь пришла генотерапия. Исследователи из США и Англии делали инъекцию вирусного вектора, содержащего исправленный ген в один глаз пациентов, страдающих амаврозом Лебера. Вектор содержал фермент, необходимый для продукции светочувствительного пигмента, и вводился в эпителий пигментного слоя сетчатки. В первом исследовании у всех 12 пациентов светочувствительность в «пролеченном» глазу вернулась. У 4 детей зрение восстановилось до такой степени, что они могли заниматься спортом и нормально учиться в школе. Кроме того, были проведены исследования на саймири (беличьи обезьянки), страдающих дальтонизмом. Инъекция «исправленных» генов вернула им полное цветовое зрение.
Список наследственных заболеваний, которые пытаются или планируют лечить генами, велик. Это и ревматоидный артрит и заболевания, связанные с недостатком гормонов (инсулина, эритропоэтина, гормона роста). В случае хронической анемии, связанной с дефицитом эритропоэтина, на основании опытов на животных предлагается принципиально новый подход к лечению. Так как каждая из наших клеток содержит один и тот же геном, можно заставить фибробласты кожи, которые в норме не производят эритропоэтина, синтезировать этот гормон. Для этого нужно ввести в геном новую контролирующую область и тем самым снять запрет со считывания (экспрессии) гена эритропоэтина, присутствующего, но «молчащего» в фибробластах.
Практически в любой области медицины либо начаты клинические испытания лечения наследственных заболеваний с помощью генотерапии, либо в опытах на животных разрабатываются подходы к такому лечению. По мере усовершенствования методов доставки генов и контроля их экспрессии список заболеваний, к которым можно применять генотерапию, будет, безусловно, расширяться.
Генотерапия применима не только к наследственным заболеваниям. Предстоит решить проблему лечения генами «чумы XX века» — синдрома приобретенного иммунодефицита (СПИД), возникающего при заражении вирусом иммунодефицита человека (ВИЧ). ВИЧ представляет собой ретровирус, поражающий Г-лимфоциты и макрофаги. Болезнь удалось бы победить, если бы были найдены новые гены, введение которых в зараженные ВИЧ лимфоциты останавливало бы дальнейшее размножение вируса. Предложено множество хитроумных способов борьбы со СПИДом с помощью привнесенных генов. Все они основаны на новейших данных о строении и функционировании генома ретровируса. Например, вводя прямо в мышцы больного ретровирусные векторы, несущие отдельные гены ВИЧ, ученые рассчитывали на то, что гены ВИЧ после внедрения в ДНК хромосом хозяина смогут дать информацию для синтеза вирусных белков и произойдет «противоСПИДная» иммунизация больного этими белками. Однако еще не получено ощутимых результатов, которые сулили бы успех в борьбе с вирусом дикого типа, коварство которого заключается в его изменчивости.
Огромные перспективы открывает использование генотерапии для лечения онкологических заболеваний. Трансгенных животных можно использовать для изучения наследственных заболеваний мозга и нервной системы. Гены болезни Альцгеймера (отложение белка Р-амилоида приводит к образованию характерных бляшек) и гены, отвечающие за развитие эпилепсии, болезней мозга вводятся в геном нормальных животных; при этом получают трансгенных животных-моделей, на которых можно испытывать различные терапевтические приемы.
Трансгенных животных стали использовать для исследования воспалительных и иммунологических заболеваний человека, например, ревматоидного артрита. Моделируются болезни, связанные с липидным обменом.
Таким образом, генетическая инженерия на сегодняшний день – это инструмент, позволяющий производить необходимые манипуляции с генетическим материалом, что приводит к улучшению состояния жизни человеческого общества.